Já faz 40 anos que pesquisadores publicaram o primeiro estudo demonstrando uma ligação direta entre o uso de antibióticos em fazendas e a disseminação da resistência aos antibióticos para as populações humanas (Levy et al., 1976). Esse estudo avaliou bactérias em animais de fazenda e trabalhadores agrícolas após a introdução de alimentação suplementada com tetraciclina. Dentro de 2 semanas, as bactérias encontradas no intestino dos animais alimentados com o suplemento de tetraciclina eram quase todas resistentes à tetraciclina. Essas bactérias resistentes à tetraciclina se espalharam para os trabalhadores da fazenda de modo que dentro de 6 meses, as fezes dos trabalhadores continham mais de 80% de bactérias resistentes à tetraciclina, em comparação com menos de 7% encontrados em amostras de vizinhos.
Assim, sabemos definitivamente há mais de 40 anos que antibióticos usados no gado resultam na disseminação direta de bactérias resistentes para os seres humanos. Nas décadas seguintes, numerosos estudos foram publicados em literatura científica, fornecendo evidências adicionais da disseminação de micróbios resistentes a antibióticos do gado para os alimentos ou para humanos (CDC, 2013b, Davis e Price, 2016, Elliott, 2015, Marshall e Levy, 2011, O’Neill, 2015, Robinson et al., 2016, Sneeringer et al., 2015). De fato, um relatório recente encomendado pelo governo britânico concluiu o seguinte:
De . . . 92 artigos, 114 (59%) declararam abertamente ou continham evidências para sugerir que o uso de antibióticos na agricultura aumenta o número de infecções resistentes em humanos. Apenas 15 (8%) argumentaram que não havia ligação entre o uso de antibióticos e resistência. Os outros 63 não tomaram uma posição clara. Além disso, a maioria dos estudos que se opõem a uma redução do uso de antimicrobianos agrícolas foram escritos por pessoas ligadas a governos ou à indústria, em contraste com a maioria dos estudos a favor da redução, que eram afiliados a universidades. Dos 139 estudos acadêmicos que a revisão encontrou, apenas sete (5%) argumentaram que não havia nenhuma ligação entre o consumo de antibióticos em animais e a resistência em seres humanos, enquanto 100 (72%) encontraram evidências de uma ligação. . . . À luz dessas informações, acredita-se que existam evidências suficientes de que o mundo precisa começar já a reduzir as quantidades de antimicrobianos usados na pecuária. (O’Neill, 2015).
O completo fracasso da nossa sociedade em lidar com essa preocupação nos Estados Unidos é profundamente decepcionante e alarmante para os profissionais de saúde que cada vez mais lutam para cuidar de pacientes infectados com bactérias resistentes aos antibióticos. Aqueles que defendem a necessidade de ainda mais estudos antes da tomada de ação têm ligações estreitas com indústrias agropecuárias que continuam a usar antibióticos.
O ESTADO ATUAL DE RESISTÊNCIA ANTIBIÓTICA
A sociedade está, sem dúvida, diante de uma crise de resistência aos antibióticos. Distintos órgãos que soam o alarme sobre a resistência aos antibióticos incluem a Organização Mundial da Saúde, os Centros de Controle e Prevenção de Doenças dos EUA, o Centro Europeu de Prevenção e Controle de Doenças, a Agência Europeia de Medicamentos, o Instituto de Medicina, o Fórum Econômico Mundial e o Conselho Consultivo Presidencial sobre Ciência e Tecnologia dos EUA (CDC, 2013b, Centro Europeu de Prevenção e Controle de Doenças, 2013, OIM, 2010, PCAST, 2014, OMS, 2012, 2014, Fórum Económico Mundial, 2013).
Os antibióticos estão entre as mais potentes intervenções que salvam vidas em toda a medicina. As reduções na mortalidade proporcionadas por antibióticos eficazes para infecções bacterianas de todos os tipos, desde simples infecções cutâneas até infecções sistêmicas, pulmão, abdômen e cérebro, são enormes (Spellberg et al., 2011). Em pouco tempo, os antibióticos reduziram a taxa de morte por infecções nos Estados Unidos em quase 80%, (Spellberg, 2010). A perda de eficácia dos antibióticos ameaça retornar a sociedade à uma época em que um em cada dez pacientes com infecção cutânea morria e um em cada três pacientes com pneumonia morria (taxas de morte superiores a 10 vezes em comparação com a era pós-antibióticos) (Spellberg et al). Sem antibióticos eficazes, a medicina seria paralisada por uma incapacidade de tratar infecções resultantes de cuidados intensivos especializados (Spellberg et al., 2008a, Spellberg et al., 2008a, Spellberg et al. Spellberg et al., 2013).
Os Centros de Controle e Prevenção de Doenças dos Estados Unidos calculam de forma muito conservadora que 23.000 americanos morrem de infecções resistentes a antibióticos todos os anos (CDC, 2013b). O número real pode ser quatro vezes maior (IDSA, 2004, Spellberg et al., 2008a, Spellberg et al., 2011).
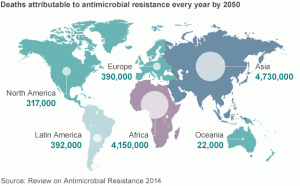
O custo anual nos Estados Unidos de tais infecções ultrapassa US $ 20 bilhões por ano (CDC, 2013b). Tais infecções não são problemas abstratos para o futuro, pois são vistas pelos profissionais de saúde todos os dias. Encontramos diariamente infecções resistentes a antibióticos de primeira linha, e não raramente encontramos infecções resistentes a todos os antibióticos, exceto colistina ou tigeciclina, dois antibióticos altamente indesejáveis devido ao excesso de toxicidade e eficácia inadequada. Também estamos vendo infecções pan-resistentes que não são tratáveis nem mesmo com colistina ou tigeciclina.
Os tipos de bactérias que causam muitas dessas infecções são encontrados no gado. As Enterobacteriaceae encontradas no gado e na carne incluem os patógenos oportunistas Escherichia coli e Klebsiella (Davis e Price, 2016, Davis et al., 2015, Nordstrom et al., 2013), as quais são as causas mais comuns de infecções do trato urinário e estão entre as mais comuns da corrente sanguínea em pacientes (Davis e Price, 2016, Diekema et al., 2003, Laupland e Church, 2014, Laupland et al., 2007, Russo e Johnson, 2003, Wisplinghoff et al., 2004). Staphylococcus aureus, a causa mais comum de infecções cutâneas e a segunda causa mais comum de infecções de corrente sanguínea em pacientes (Brook e Frazier, 1995, Carratala et al., 2003, Sigurdsson e Gudmundsson, 1989, Wisplinghoff et al (Smith, Wardyn, 2015), também se encontra na pele do gado e na carne comercializada. (Smith, 2015). Estes organismos se movem facilmente entre animais de fazenda e seres humanos e também de humanos para outros humanos na comunidade e em ambientes de cuidados de saúde. Tais bactérias intestinais e da pele representam uma proporção significativa das infecções resistentes aos antibióticos e mortes resultantes nos Estados Unidos e em todo o mundo. Além disso, eles podem servir como repositórios de informações genéticas codificando a resistência que pode então se espalhar para outros tipos de bactérias que infectam os seres humanos.
Temos uma crise de resistência aos antibióticos. O problema é multifatorial e não pode ser abordado por uma única intervenção. Será necessária uma abordagem multidisciplinar para combater o problema (Spellberg et al., 2013). Não seremos resgatados por novos antibióticos que chegam ao mercado e sendo assim, não temos escolha, devemos tornar muito mais efetiva a preservação dos preciosos antibióticos que temos atualmente.
O PRINCÍPIO DA CONFIANÇA SOCIAL
À medida que consideramos o quadro de soluções políticas para combater a resistência aos antibióticos, existe um princípio fundamental que deve estar no centro dos nossos esforços. Os antibióticos são únicos entre todas as drogas e praticamente únicos entre todas as tecnologias, na medida em que sofrem de perda de eficácia transmissível ao longo do tempo (Spellberg et al., 2013; Spellberg et al., 2016). Como as bactérias resistentes aos antibióticos se espalham de pessoa para pessoa, o uso de antibióticos por cada indivíduo afeta a capacidade de cada outra pessoa usar os mesmos antibióticos. O uso de um antibiótico afeta nossa capacidade de usá-los. Nosso uso afeta a capacidade futura de seus netos de usá-los. Os antibióticos são, portanto, uma confiança social compartilhada. Não é aceitável um grupo de pessoas abusar desta confiança com o objetivo de vantagem econômica, enquanto prejudica todos os outros.
Na civilização ocidental, os direitos do indivíduo têm sido primordiais desde a Carta Magna e o estabelecimento de princípios de direito comum. Uma vez que as ações de um indivíduo afetam negativamente outros, no entanto, limites são colocados sobre essas liberdades. Por exemplo, nos Estados Unidos reconhecemos os direitos dos adultos a consumir álcool, até o ponto de beberem até a morte. Porém, nenhuma pessoa tem o direito de beber álcool e dirigir um carro, pilotar um avião, ou fazer uma cirurgia. O primeiro só afeta o indivíduo. O último afeta outros na sociedade. O princípio por trás do uso de antibióticos é o mesmo. Temos o direito de usá-los para beneficiar os pacientes, mas não abusar deles para obter vantagem financeira, prejudicando outros.
Alexander Fleming, o descobridor da penicilina, alertou o público sobre o abuso de antibióticos em uma entrevista de 1945 no New York Times. Ele disse: “Os micróbios são educados para resistir à penicilina e uma série de organismos penicilina-resistentes são criados. . . . Nesses casos, a pessoa irrefletida que brinca com a penicilina é moralmente responsável pela morte do homem que finalmente sucumbe à infecção com o organismo resistente à penicilina. Espero que este mal possa ser evitado “(o localizador da penicilina ensaiou seu futuro, 1945). Assim, há 71 anos, o homem que trouxe a penicilina para a civilização também trouxe em relevo específico as conseqüências morais de abusar dessa preciosa confiança societária.
USO ANTIBIÓTICO NA EXPLORAÇÃO AGRÍCOLA
Sabe-se desde o final da década de 1940 que a alimentação de concentrações sub-terapêuticas de antibióticos para o gado faz com que os animais cresçam maiores, mais rápido e sai mais barato (Coates et al., 1951, Elliott, 2015, Moore et al., 1946, Sneeringer et al. Al., 2015, Stokstad e Jukes, 1950). O mecanismo deste efeito permanece obscuro após mais de 60 anos. Evidências recentes de ratos sugerem que o efeito pode ser devido a alterações na microbiota intestinal, resultando em diminuição da extração de calorias dos alimentos pelas bactérias, deixando mais disponível ao hospedeiro para absorver (Cho et al., 2012).
Na Europa Ocidental, foram feitos esforços nos últimos 10 a 20 anos para frear a promoção do crescimento antimicrobiano e o uso de antibióticos profiláticos na pecuária (Marshall e Levy, 2011; O’Neill, 2015). Tais esforços foram em grande parte impossíveis nos Estados Unidos por causa da política. Mesmo que os Estados Unidos continuando a experimentar a crescente crise de resistência aos antibióticos nos últimos 15 anos, a quantidade ajustada de peso de antibióticos adquiridos para uso em gado aumentou em aproximadamente 50% (de 0,2 a 0,3 gramas de antibiótico por quilo de Peso animal) (Instituto de Saúde Animal, 2008, FDA, 2015, Poultry Site, 2005, USDA, 2016a, 2016b). É impressionante que a produção pecuária dos EUA use de duas a oito vezes mais antibióticos (por quilo de peso corporal de gado) do que países comparáveis na Europa Ocidental (O’Neill, 2015).
A carga assustadora de agentes antimicrobianos colocados no gado nos Estados Unidos é difícil de entender. Em 2014, as vendas nos EUA de antibióticos para uso no gado totalizaram 15,4 milhões de quilos de agentes antimicrobianos, ou seja, 34 milhões de libras, ou 17 mil toneladas (FDA, 2015). Isso é quatro vezes mais antimicrobianos do que são comprados para uso em seres humanos nos Estados Unidos (cerca de 3,5 milhões de quilos). Assim, os antimicrobianos para gado representam 80% dos antimicrobianos comprados nos Estados Unidos. O uso total de antimicrobianos em animais também reflete um aumento de uso de mais de 20% nos últimos 5 anos, período durante o qual médicos e sociedades médicas têm chamado atenção para os avisos sobre a crise de resistência aos antibióticos (Spellberg et al., 2013).
Bactérias resistentes criadas em gado se espalham para humanos por múltiplas vias. As bactérias resistentes dos animais são derramadas no solo e nas águas subterrâneas, contaminam diretamente os trabalhadores agrícolas, que podem então espalhar essas bactérias em comunidades humanas através de fomites e contato direto e contaminar a carne durante o manuseio no frigorífico. De fato, amostras de produtos de carne em lojas de alimentos revelam consistentemente altas taxas de Enterobacteriaceae em frango, peru, carne de porco e carne bovina (Elliott, 2015; Johnson et al., 2006, Making the world safe from superbugs, 2016; NARMS, 2013b; O’Neill, 2015, Sneeringer et al., 2015). Uma proporção alarmante dessas bactérias são resistentes aos antibióticos, e quando manuseia-se a carne antes de cozinhar ou ingere-se carne não totalmente cozida, pode-se também ingerir as bactérias resistentes aos antibióticos. Os Centros de Controle e Prevenção de Doenças dos Estados Unidos estimaram que esta via de transmissão é responsável por 20% das infecções resistentes aos antibióticos em seres humanos (CDC, 2013a, b, Making the world safe from superbugs, 2016). A porcentagem real pode muito bem ser substancialmente maior, pois é difícil dar conta de rodadas adicionais de transmissão de humano para humano após a introdução inicial de bactérias resistentes de animais para humanos.
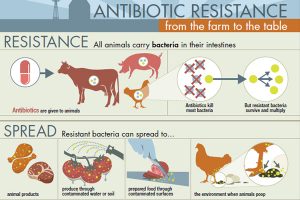
Estudos de vigilância confirmaram em larga escala as observações originais de 1976 do Dr. Levy – a introdução de fluoroquinolonas para uso na Espanha em 1990 foi seguida por um aumento marcado e acelerado de infecções por Enterobacteriaceae resistente a fluoroquinolonas em humanos (Silbergeld et al., 2008) . Um fenômeno semelhante ocorreu quando as fluoroquinolonas começaram a ser usadas na pecuária nos Estados Unidos (Gupta et al., 2004).
Além disso, a Dinamarca e outros países da União Europeia aplicaram com êxito a proibição da utilização sistemática de antibióticos (quer para a promoção do crescimento quer para a prevenção de doenças), o que levou a reduções drásticas nas taxas de resistência clínica dos doentes a alguns dos antibióticos alvo ( DANMAP, 2015, Elliott, 2015, O’Neill, 2015, Robinson et al., 2016). Exemplos específicos adicionais de sucesso associados a reduções dirigidas a uma determinada classe de antibióticos também podem ser encontrados nos Estados Unidos e no Canadá. Por exemplo, em Quebec, a eliminação do uso de cefalosporina em ovos de frango de corte levou a declínios acentuados de Enterobacteriaceae resistentes à cefalosporina tanto em carne de frango quanto em seres humanos, embora o uso humano de antibióticos se mantivesse constante (Dutil et al., 2010). Quando a indústria de frango retomou parcialmente a injeção de cefalosporina em ovos de frango de corte em 2006-2007, a resistência à cefalosporina começou a aumentar novamente tanto em animais como em seres humanos. Do mesmo modo, para uso em aves, os Estados Unidos instituíram uma proibição total de fluoroquinolonas em 2005 e uma proibição parcial de cefalosporinas em 2012 (NARMS, 2013a, 2014). Subseqüentemente, os testes do FDA em 2014 não encontraram resistência a fluoroquinolona em amostras de aves no mercado e declínio das taxas de resistência à ceftriaxona em Salmonella (FDA, 2016).
O fato de que as políticas nacionais de proibição do crescimento promocional e uso profilático rotineiro de antibióticos levaram a reversões nas taxas de resistência aos antibióticos em pessoas reforça o argumento de que a alimentação de antibióticos para animais contribui para a propagação da resistência aos antibióticos para populações humanas. Dois fatos são incontestáveis: (1) a adição de antibióticos aos alimentos e à água dos animais contribui para a propagação de bactérias resistentes aos seres humanos; E (2) muitas partes promovem o uso rotineiro de antibióticos no gado especificamente porque percebem (possivelmente incorretamente) que isso permite que as indústrias de carne, aves e medicamentos maximizem a produção e os lucros. Assim, um grupo de pessoas na sociedade está usando antibióticos de forma imprudente para mascarar práticas de gestão visando ganhos e lucros a curto prazo, contribuindo para a propagação de bactérias resistentes aos antibióticos para outras pessoas na sociedade.
Uma das justificativas habituais oferecidas pelos porta-vozes da indústria agrícola e farmacêutica para evitar até mesmo modestas restrições sobre o uso de antibióticos na produção pecuária é que a maioria dos antibióticos utilizados no gado não é “medicamente importante”. Esta afirmação é falsa. Dos antibióticos vendidos para uso em gado em 2014, 9,5 milhões de quilos eram idênticos ou muito semelhantes aos utilizados em seres humanos (FDA, 2015). Além disso, alguns dos fármacos que não são considerados “medicamente importantes” são semelhantes em termos de mecanismo aos antibióticos usados em seres humanos e têm potencial para desencadear a resistência cruzada (Marshall e Levy, 2011).
Imagine a reação dos pacientes e do público se os hospitais adotassem um modelo semelhante e amontoassem 10 pacientes em uma sala de hospital para economizar dinheiro, dando-lhes todos os antibióticos de amplo espectro para tentar evitar as infecções que inevitavelmente viriam a seguir.

CONCLUSÕES
A comunidade humana global tem uma crise contínua e agravada de infecções resistentes a antibióticos em pacientes. Não podemos contar com novos antibióticos para nos salvar desta crise. Temos de fazer um trabalho muito melhor de preservar a eficácia dos antibióticos que temos agora. Portanto, devemos usar menos antibióticos. Como quase 80 por cento do uso de antimicrobianos nos Estados Unidos está na pecuária, devemos fazer um trabalho muito melhor de reduzir o uso de antibióticos tanto no gado como nos seres humanos.
O ponto fundamental é que os micróbios resistentes aos antibióticos podem passar de animais alimentados com antibióticos para humanos, que os pacientes são prejudicados como resultado deste processo e que, em alguns países, as políticas nacionais que eliminam a promoção do crescimento e o uso profilático rotineiro reverteram ou retardaram as taxas de resistência aos antibióticos.
Assim, de uma perspectiva de política, a verdadeira questão é: quais são os “prós” do uso antimicrobiano em animais que podem levar a sociedade a concordar em assumir os “contras” correspondentes – o risco de prejudicar os seres humanos por esse uso? O pró é a capacidade das fazendas industriais para tomar atalhos na criação de animais para aumentar o potencial de lucro. Assim, esta questão – como tantos outros – se resume a prioridades da sociedade. Esta não é uma questão de ciência, é uma questão de política.
Finalmente, uma lição crítica deste diálogo não foi claramente afirmada. Se reduzimos a quantidade de antibióticos dados aos animais em 50% por animal, mas aumentarmos em duas vezes o numero de animais, ainda estaremos expondo as bactérias no ambiente de produção de alimentos à mesma quantidade de antibióticos, levando à resistência aos antibióticos. Como uma sociedade, se quisermos reduzir a seleção de bactérias resistentes aos antibióticos, e assim reduzir o risco de infecções resistentes aos antibióticos, devemos consumir menos carne. Essa oportunidade real e transformadora tem recebido atenção insuficiente a nível de políticas nacionais de saúde e comércio.
Referências:
Antibiotic Resistance in Humans and Animals. Brad Spellberg, Gail R. Hansen, Avinash Kar, Carmen D. Cordova, Lance B. Price, and James R. Johnson. June 22, 2016
Animal Health Institute. 2008. 2007 Antibiotics sales. http://www.ahi.org/archives/2008/11/2007- antibiotics-sales/ (accessed May 14, 2016).
Brook, I., and E. H. Frazier. 1995. Clinical features and aerobic and anaerobic microbiological characteristics of cellulitis. Archives of Surgery 130(7):786–792.
Carratala, J., B. Roson, N. Fernandez-Sabe, E. Shaw, O. del Rio, A. Rivera, and F. Gudiol. 2003. Factors associated with complications and mortality in adult patients hospitalized for infectious cellulitis. European Journal of Clinical Microbiology and Infectious Diseases 22(3):151–157.
CDC (U.S. Centers for Disease Control and Prevention). 2013a. Antibiotic resistance from the farm to the table. http://www.cdc.gov/foodsafety/challenges/from-farm-to-table.html (accessed May 17, 2016).
CDC. 2013b. Antibiotic resistant threats in the United States, 2013. http://www.cdc.gov/drugresistance/threat-report-2013/pdf/ar-threats-2013-508.pdf (accessed November 16, 2013).
Cho, I., S. Yamanishi, L. Cox, B. A. Methe, J. Zavadil, K. Li, Z. Gao, D. Mahana, K. Raju, I. Teitler, H. Li, A. V. Alekseyenko, and M. J. Blaser. 2012. Antibiotics in early life alter the murine colonic microbiome and adiposity. Nature 488(7413):621–626.
Coates, M. E., C. D. Dickinson, G. F. Harrison, S. K. Kon, S. H. Cummins, and W. F. Cuthbertson. 1951. Mode of action of antibiotics in stimulating growth of chicks. Nature 168(4269):332.
DANMAP (Danish Integrated Antimicrobial Resistance Monitoring and Research Programme). 2015.
Danmap 2014: Use of antimicrobial agents and occurrence of antimicrobial resistance in bacteria from food animals, food and humans in Denmark. http://www.danmap.org/~/media/Projekt%20sites/Danmap/DANMAP%20reports/DANMAP%20 2014/Danmap_2014.ashx (accessed May 14, 2016).
Davis, G. S., and L. B. Price. 2016. Recent research examining links among klebsiella pneumoniae from food, food animals, and human extraintestinal infections. Current Environmental Health Reports 3(2):128–135.
Davis, G. S., K. Waits, L. Nordstrom, B. Weaver, M. Aziz, L. Gauld, H. Grande, R. Bigler, J. Horwinski, S. Porter, M. Stegger, J. R. Johnson, C. M. Liu, and L. B. Price. 2015. Intermingled klebsiella pneumoniae populations between retail meats and human urinary tract infections. Clinical Infectious Diseases 61(6):892–899.
Diekema, D. J., M. A. Pfaller, F. J. Schmitz, J. Smayevsky, J. Bell, R. N. Jones, and M. Beach. 2001. Survey of infections due to staphylococcus species: Frequency of occurrence and antimicrobial susceptibility of isolates collected in the United States, Canada, Latin America, Europe, and the Western Pacific Region for the sentry antimicrobial surveillance program, 1997–1999. Clinical Infectious Diseases 32(Suppl 2):S114–S132.
Diekema, D. J., S. E. Beekmann, K. C. Chapin, K. A. Morel, E. Munson, and G. V. Doern. 2003. Epidemiology and outcome of nosocomial and community-onset bloodstream infection. Journal of Clinical Microbiology 41(8):3655–3660.
Dutil, L., R. Irwin, R. Finley, L. K. Ng, B. Avery, P. Boerlin, A. M. Bourgault, L. Cole, D. Daignault, A. Desruisseau, W. Demczuk, L. Hoang, G. B. Horsman, J. Ismail, F. Jamieson, A. Maki, A. Pacagnella, and D. R. Pillai. 2010. Ceftiofur resistance in Salmonella enterica serovar heidelberg from chicken meat and humans, Canada. Emerging Infectious Diseases 16(1):48–54.
Elliott, K. 2015. Antibiotic on the farm: Agriculture’s role in drug resistance. Center for Global Development. http://www.cgdev.org/sites/default/files/CGD-Policy-Paper-59-Elliott-Antibiotics- Farm-Agriculture-Drug-Resistance.pdf (accessed May 8, 2016).
European Centre for Disease Prevention and Control. 2013. Antimicrobial resistance surveillance in Europe 2012. Annual Report of the European Antimicrobial Resistance Surveillance Network (EARS-Net). Stockholm: European Centre for Disease Prevention and Control.
FDA (U.S. Food and Drug Administration). 2015. Summary report on antimicrobials sold or distributed for use in food-producing animals. http://www.fda.gov/downloads/ForIndustry/UserFees/AnimalDrugUserFeeActADUFA/UCM476 258.pdf (accessed May 8, 2016).
FDA. 2016. FDA NARMS retail meat interim report for salmonella shows encouraging early trends continue; includes whole genome sequencing data for the first time. http://www.fda.gov/AnimalVeterinary/NewsEvents/CVMUpdates/ucm498038.htm; http://www.fda.gov/downloads/AnimalVeterinary/SafetyHealth/AntimicrobialResistance/Nationa lAntimicrobialResistanceMonitoringSystem/UCM498134.pdf (accessed May 8, 2016).
Gupta, A., J. M. Nelson, T. J. Barrett, R. V. Tauxe, S. P. Rossiter, C. R. Friedman, K. W. Joyce, K. E. Smith, T. F. Jones, M. A. Hawkins, B. Shiferaw, J. L. Beebe, D. J. Vugia, T. Rabatsky-Ehr, J. A. Benson, T. P. Root, F. J. Angulo, and N. W. Group. 2004. Antimicrobial resistance among campylobacter strains, United States, 1997–2001. Emerging Infectious Diseases 10(6):1102– 1109.
IDSA (Infectious Disease Society of America). 2004. Bad bugs, no drugs. White Paper. Alexandria, VA: Infectious Diseases Society of America.
IOM (Institute of Medicine). 2010. Antibiotic resistance: Implications for global health and novel intervention strategies: Workshop summary. Edited by E. R. Choffnes, D. A. Relman, and A. Mack. Washington, DC: The National Academies Press.
Johnson, J. R., M. A. Kuskowski, M. Menard, A. Gajewski, M. Xercavins, and J. Garau. 2006. Similarity between human and chicken Escherichia coli isolates in relation to ciprofloxacin resistance status. Journal of Infectious Diseases 194(1):71–78.
Laupland, K. B., and D. L. Church. 2014. Population-based epidemiology and microbiology of community-onset bloodstream infections. Clinical Microbiology Reviews 27(4):647–664.
Laupland, K. B., D. B. Gregson, W. W. Flemons, D. Hawkins, T. Ross, and D. L. Church. 2007. Burden of community-onset bloodstream infection: A population-based assessment. Epidemiology and Infection 135(6):1037–1042.
Levy, S. B., G. B. FitzGerald, and A. B. Macone. 1976. Changes in intestinal flora of farm personnel after introduction of a tetracycline-supplemented feed on a farm. New England Journal of Medicine 295(11):583–588.
Making the world safe from superbugs. 2016. Consumer Reports. http://www.consumerreports.org/cro/health/making-the-world-safe-from-superbugs/index.htm (accessed May 8, 2016).
Marshall, B. M., and S. B. Levy. 2011. Food animals and antimicrobials: Impacts on human health. Clinical Microbiology Reviews 24(4):718–733.
Meat on drugs. 2012. Consumer Reports. http://www.consumerreports.org/content/dam/cro/news_articles/health/CR%20Meat%20On%20 Drugs%20Report%2006-12.pdf (accessed May 8, 2016).
Moore, P. R., A. Evenson, T.D. Luckey, E. McCoy, C.A. Elvehjem, and E.B. Hart. 1946. Use of sulfasuxidine, streptothricin, and streptomycin in nutritional studies with the chick. Journal of Biological Chemistry 165(2):437–441.
NARMS (National Antimicrobial Resistance Monitoring System). 2013a. 2012 Retail meat report. U.S. Food and Drug Administration.
http://www.fda.gov/downloads/AnimalVeterinary/SafetyHealth/AntimicrobialResistance/Nationa
lAntimicrobialResistanceMonitoringSystem/UCM442212.pdf (accessed May 8, 2016). NARMS. 2013b. The national antimicrobial resistance monitoring system: Enteric bacteria. U.S. Food
and Drug Administration. http://www.fda.gov/downloads/AnimalVeterinary/SafetyHealth/AntimicrobialResistance/Nationa lAntimicrobialResistanceMonitoringSystem/UCM453398.pdf (accessed May 8, 2016).
NARMS. 2014. NARMS integrated report: 2012–2013. U.S. Food and Drug Administration. http://www.fda.gov/downloads/AnimalVeterinary/SafetyHealth/AntimicrobialResistance/Nationa lAntimicrobialResistanceMonitoringSystem/UCM453398.pdf (accessed May 8, 2016).
Netherlands Ministry of Economic Affairs. 2014. Reduced and responsible: Use of antibiotics in food- producing animals in the Netherlands.
https://www.government.nl/documents/leaflets/2014/02/28/reduced-and-responsible-use-of-
antibiotics-in-food-producing-animals-in-the-netherlands (accessed May 8, 2016). Netherlands Ministry of Economic Affairs. 2016. AMR next: EU Antimicrobial Resistance One Health
Ministry Conference 2016. https://www.government.nl/topics/antibiotic- resistance/documents/leaflets/2016/04/18/factsheet-eu-antimicrobial-resistance-one-health- ministerial-conference-2016 (accessed May 8, 2016).
Nordstrom, L., C. M. Liu, and L. B. Price. 2013. Foodborne urinary tract infections: A new paradigm for antimicrobial-resistant foodborne illness. Frontiers in Microbiology 4:29.
O’Neill, J. 2015. Antimicrobials in agriculture and the environment: Reducing unnecessary use and waste: The review on antimicrobial resistance. http://amr- review.org/sites/default/files/Antimicrobials%20in%20agriculture%20and%20the%20environme nt%20-%20Reducing%20unnecessary%20use%20and%20waste.pdf (accessed May 8, 2016).
Organic Trade Association. 2012. Consumer-driven U.S. organic market surpasses $31 billion in 2011. https://www.ota.com/news/press-releases/17093 (accessed May 8, 2016).
Organic Trade Association. 2014. American appetite for organic products breaks through $35 billion mark. https://www.ota.com/news/press-releases/17165 (accessed May 8, 2016).
PCAST (President’s Council of Advisors on Science and Technology). 2014. Report to the president on combating antibiotic resistance. Executive Office of the President. http://www.whitehouse.gov/sites/default/files/microsites/ostp/PCAST/pcast_carb_report_sept201 4.pdf (accessed January 2, 2015).
Penicillin’s finder assays its future. 1945. New York Times, June 26.
Perrone, M. 2012. Does giving antibiotics to animals hurt humans? USA Today, April 20.
http://usatoday30.usatoday.com/news/health/story/2012-04-20/antibiotics-animals-human-
meat/54434860/1 (accessed May 8, 2016).
Poultry Site. Antibiotic use in U.S. animals rises in 2004. 2005.
http://www.thepoultrysite.com/poultrynews/7985/antibiotic-use-in-us-animals-rises-in-2004/
(accessed May 14, 2016).
Robinson, T. P., H. F. Wertheim, M. Kakkar, S. Kariuki, D. Bu, and L. B. Price. 2016. Animal production
and antimicrobial resistance in the clinic. Lancet 387(10014):e1–3.
Russo, T. A., and J. R. Johnson. 2003. Medical and economic impact of extraintestinal infections due to
Escherichia coli: Focus on an increasingly important endemic problem. Microbes and Infection
5(5):449–456.
Sigurdsson, A. F., and S. Gudmundsson. 1989. The etiology of bacterial cellulitis as determined by fine-
needle aspiration. Scandinavian Journal of Infectious Diseases 21(5):537–542.
Silbergeld, E. K., J. Graham, and L. B. Price. 2008. Industrial food animal production, antimicrobial
resistance, and human health. Annual Review of Public Health 29:151–169.
Smith, T. C. 2015. Livestock-associated Staphylococcus aureus: The United States experience. PLoS
Pathogens 11(2):e1004564.
Smith, T. C., and S. E. Wardyn. 2015. Human infections with Staphylococcus aureus cc398. Current
Environmental Health Reports 2(1):41–51.
Sneeringer, S., J. MacDonald, N. Key, W. McBride, and K. Mathews. 2015. Economics of antibiotic use
in U.S. livestock production. U.S. Department of Agriculture.
http://www.ers.usda.gov/media/1950577/err200.pdf (accessed May 8, 2016).
Spellberg, B. 2008. Antibiotic resistance and antibiotic development. Lancet Infectious Diseases 8:211–
212.
Spellberg, B. 2009. Rising plague: The global threat from deadly bacteria and our dwindling arsenal to
fight them. New York: Prometheus Press.
Spellberg, B. 2010. The antibacterial pipeline: Why is it drying up, and what must be done about it? In
Antibiotic resistance: Implications for global health and novel intervention strategies: Workshop summary. Washington, DC: The National Academies Press. Pp. 299–332.
Spellberg, B. 2011. The antibiotic crisis: Can we reverse 65 years of failed stewardship? Archives of Internal Medicine 171(12):1080–1081.
Spellberg, B., R. Guidos, D. Gilbert, J. Bradley, H. W. Boucher, W. M. Scheld, J. G. Bartlett, and J. Edwards, Jr. 2008a. The epidemic of antibiotic-resistant infections: A call to action for the medical community from the Infectious Diseases Society of America. Clinical Infectious Diseases 46(2):155–164.
Spellberg, B., G. H. Talbot, E. P. Brass, J. S. Bradley, H. W. Boucher, and D. Gilbert. 2008b. Recommended design features of future clinical trials of anti-bacterial agents for community- acquired pneumonia. Position Paper. Clinical Infectious Diseases 47(S3):S249–S265.
Spellberg, B., G. H. Talbot, H. W. Boucher, J. S. Bradley, D. Gilbert, W. M. Scheld, J. E. J. Edwards, and J. G. Bartlett. 2009. Antimicrobial agents for complicated skin and skin structure infections: Justification of non-inferiority margins in the absence of placebo-controlled trials. Clinical Infectious Diseases 49:383–391.
Spellberg, B., M. Blaser, R. Guidos, H. W. Boucher, J. S. Bradley, B. Eisenstein, D. Gerding, R. Lynfield, L. B. Reller, J. Rex, D. Schwartz, E. Septimus, F. C. Tenover, and D. N. Gilbert. 2011. Combating antimicrobial resistance: Policy recommendations to save lives. Clinical Infectious Diseases 52(S5):S397–S428.
Spellberg, B., J. G. Bartlett, and D. N. Gilbert. 2013. The future of antibiotics and resistance. New England Journal of Medicine 368(4):299–302.
Spellberg, B., A. Srinivasan, and H. F. Chambers. 2016. New societal approaches to empowering antibiotic stewardship. Journal of the American Medical Association 315(12):1229–1230.
Stokstad, E. L. R., and T. H. Jukes. 1950. Further observations on the “animal protein factor.” Experimental Biology and Medicine 73:523–528.
Teillant, A., and R. Laxminarayan. 2015. Economics of antibiotic use in U.S. swine and poultry production. Choices. http://www.choicesmagazine.org/choices-magazine/theme-articles/theme- overview/economics-of-antibiotic-use-in-us-swine-and-poultry-production (accessed May 14, 2016).
USDA (U.S. Department of Agriculture). 2016a. Livestock slaughter annual summary. http://usda.mannlib.cornell.edu/MannUsda/viewDocumentInfo.do?documentID=1097 (accessed May 14, 2016).
USDA. 2016b. Poultry slaughter. http://usda.mannlib.cornell.edu/MannUsda/viewDocumentInfo.do?documentID=1131 (accessed May 14, 2016).
WHO (World Health Organization). 2012. The evolving threat of antimicrobial resistance: Options for action. http://apps.who.int/iris/bitstream/10665/44812/1/9789241503181_eng.pdf (accessed May 8, 2016)
WHO. 2014. Antimicrobial resistance: Global report on surveillance. http://apps.who.int/iris/bitstream/10665/112642/1/9789241564748_eng.pdf?ua=1 (accessed May 5, 2014).
Wisplinghoff, H., H. Seifert, S. M. Tallent, T. Bischoff, R. P. Wenzel, and M. B. Edmond. 2003a. Nosocomial bloodstream infections in pediatric patients in United States hospitals: Epidemiology, clinical features and susceptibilities. Pediatric Infectious Disease Journal 22(8):686–691.
Wisplinghoff, H., H. Seifert, R. P. Wenzel, and M. B. Edmond. 2003b. Current trends in the epidemiology of nosocomial bloodstream infections in patients with hematological malignancies and solid neoplasms in hospitals in the United States. Clinical Infectious Diseases 36(9):1103– 1110.
Wisplinghoff, H., T. Bischoff, S. M. Tallent, H. Seifert, R. P. Wenzel, and M. B. Edmond. 2004. Nosocomial bloodstream infections in US hospitals: Analysis of 24,179 cases from a prospective nationwide surveillance study. Clinical Infectious Diseases 39(3):309–317.
World Economic Forum. 2013. Global risks. 8th ed. http://www3.weforum.org/docs/WEF_GlobalRisks_Report_2013.pdf (accessed November 16, 2013).